Оксиды и соли как строительные материалы реферат по химии

Современная химия является одной из естественных наук и определяет собой систему отдельных дисциплин: общей и неорганической химии, аналитической химии, органической химии, физической и коллоидной химии, геохимии, космохимии и т. п.
Химия – наука, изучающая процессы превращения веществ, сопровождающиеся изменением состава и структуры, а также взаимные переходы между этими процессами и другими формами движения материи.
Неорганическая химия – это химия элементов Периодической системы и образованных ими простых и сложных веществ.
Неорганическая химия неотделима от общей химии. Исторически при изучении химического взаимодействия элементов друг с другом были сформулированы основные законы химии, общие закономерности протекания химических реакций: теория химической связи, учение о растворах и многое другое, что составляет предмет общей химии. Таким образом, общая химия изучает теоретическое представление и концепции, составляющие фундамент всей системы химических знаний.
Неорганическая химия давно перешагнула стадию описательной науки и в настоящее время переживает своё «второе рождение» в результате широкого привлечения квантово-химических методов, зонной модели энергетического спектра электронов, открытых валентно-химических соединений благородных газов, целенаправленного синтеза материалов с особыми физическими и химическими свойствами. На основе глубокого изучения зависимости между химическим строением и свойствами она решает главную задачу – создание новых неорганических веществ с заданными свойствами. Из экспериментальных методов химии важнейшим является метод химических реакций. Химические реакции – это превращение одних веществ в другие, путем изменения состава и химического строения. Во-первых, химические реакции дают возможность исследовать химические свойства вещества. Кроме того, по химическим реакциям исследуемого вещества можно косвенно судить о его химическом строении. Прямые же методы установления химического строения в большинстве своем основаны на использовании физических явлений. Во-вторых, на основе химических реакций осуществляется неорганический синтез.
Таким образом, главным объектом химии являются вещества и их превращения.
Все вещества делятся на простые и сложные. Простые, в свою очередь, подразделяются на металлы и неметаллы.
В твердом состоянии большинство веществ имеют кристаллическое строение. Связь в кристаллической решетке металлов – металлическая. Это обуславливает их особые физические свойства: электропроводность, теплопроводность, пластичность. Атомы неметаллов связаны между собой с помощью неполярной ковалентной связи. Они могут иметь атомную (алмаз, графит, кремний) или молекулярную (белый фарфор, галогены, кристаллическая сера S8) кристаллическую решетки. Поэтому физические свойства неметаллов весьма различны.
3 стр., 1196 слов
Свойства катализатор химическое вещество ускоряющее реакцию но .
. катализатора Каталитическая активность, активность катализатора, свойство катализатора ускорять химическую реакцию. . наносят катализатор. При нанесении каталитических веществ на пористый носитель . каталитический реакция катализатор хинолин Список использованной литературы [Электронный ресурс]//URL: https://drprom.ru/kontrolnaya/smennyie-kataliticheskie-neytralizatoryi/ 1. Вольхин, В.В. Общая химия. .
Сложные вещества делятся на 4 класса: оксиды, основания, кислоты, соли.
1. Определение оксидов
Окси́д (о́кисел, о́кись) — бинарное соединение химического элемента с кислородом в степени окисления −2, в котором сам кислород связан только с менее электроотрицательным элементом. Химический элемент кислород по электроотрицательности второй после фтора, поэтому к оксидам относятся почти все соединения химических элементов с кислородом. К исключениям относятся, соединения, содержащие атомы кислорода, связанные химической связью друг с другом ( пероксиды, надпероксиды, озониды) например: пероксид натрия Na2O2 , надпероксид калия KO2 , озонид калия KO3 и соединения фтора с кислородом (OF2 , O2F2), которые следует называть не оксидами фтора, а фторидами кислорода, т. к. степень окисления кислорода в них положительная.
Оксиды — весьма распространённый тип соединений, содержащихся в земной коре и во Вселенной вообще. Примерами таких соединений являются ржавчина, вода, песок, углекислый газ, ряд красителей. Оксидами называется класс минералов, представляющих собой соединения металла с кислородом.
Часто используют и другие наименования оксидов по числу атомов кислорода: если оксид содержит только один атом кислорода, то его называют монооксидом, моноокисью или закисью, если два — диоксидом или двуокисью, если три — то триоксидом или триокисью и т. д. Например: монооксид углерода CO, диоксид углерода СО2, триоксид серы SO3.
Также распространены исторически сложившиеся (тривиальные) названия оксидов, например угарный газ CO, серный ангидрид SO3 и т. д.
2. Классификация оксидов
Несолеобразующие оксиды — оксиды, не проявляющие ни кислотных, ни основных, ни амфотерных свойств и не образующие соли. Раньше такие оксиды называли индифферентными или безразличными, но это неверно, так как по своей химической природе данные оксиды достаточно реакционноспособны. По сравнению с другими видами, количество несолеобразующих оксидов невелико, их как правило образуют одно — и двухвалентные неметаллы. Типичными представителями таких оксидов являются гемиоксид азота (закись азота) N2O, монооксид азота NO, монооксид углерода СО, монооксид кремния SiO.
Солеобразующие оксиды — это оксиды, которые образуют соли при взаимодействии с кислотами или основаниями. В зависимости от характера соответствующих гидратов оксидов все солеобразующие оксиды делятся па три типа: основные, кислотные, амфотерные.
Осно́вные оксиды – солеобразующие оксиды, проявляющие осно́вные свойства. К ним относятся:
- оксиды металлов главной подгруппы первой группы (щелочные металлы)
- оксиды металлов главной подгруппы второй группы (щелочноземельные металлы)
- оксиды переходных металлов в низших степенях окисления
Кислотные оксиды (ангидриды) – оксиды, растворяющиеся только в щелочах, с образованием соли и воды. Образуются типичными неметаллами и некоторыми переходными элементами. Элементы в кислотных оксидах обычно проявляют валентность от IV до VII. Также они могут взаимодействовать с некоторыми основными оксидами, например: оксид кальция CaO, оксид натрия Na2О и оксид цинка ZnO.
6 стр., 2581 слов
Реферат кислоты основания соли оксиды
. соли. Многие кислородосодержащие кислоты можно получить путем взаимодействия кислотных оксидов с водой: SO + HO = HSO NO + HO = 2HNO 2.1. Химические свойства кислот 1ое свойство: кислоты действуют на . 2HO = Ca(OH) + H Б) с оксидами активных металлов, образуя растворимые основания – щелочи. CaO + HO = Ca(OH) Оксиды которым соответствуют основания (независимо от того, реагируют они с водой .
Амфотерные оксиды — солеобразующие оксиды, проявляющие в зависимости от условий либо осно́вные, либо кислотные свойства (то есть проявляющие амфотерность).
Образуются переходными металлами. Металлы в амфотерных оксидах обычно проявляют валентность II,III,IV.
Увеличение степени окисления элемента и уменьшение радиуса его иона (при этом происходит уменьшение эффективного отрицательного заряда на этоме кислорода) делают оксид более кислотным. Это и объясняет закономерное изменение свойств оксидов от основных к амфотерным и далее к кислотным.
1) В одном периоде при увеличении порядкового номера происходит усиление кислотных свойств оксидов и увеличение силы соответствующих им кислот.
2) В главных подгруппах периодической системы при переходе от одного элемента к другому сверху вниз наблюдается усиление новых свойств оксидов:
3) При повышении степени окисления элемента усиливаются кислотные свойства оксида и ослабевают основные.
3. Физические и химические свойства
Физические и химические свойства оксидов очень отличаются. При комнатной температуре большинство оксидов являются твердыми веществами, например, меди (II) оксид CuO черного цвета, кальций оксид CaO белого цвета, хром (III) оксид Cr 2 O3 темно-зеленого цвета. Некоторые оксиды являются жидкостями, например, водород оксид (вода) H2 O и Cl2 O7 являются бесцветными жидкостями, а некоторые — газообразными веществами, например карбон (IV) оксид CO2 является газом без цвета, а азот (IV) оксид NO2 являются бурым газом. Некоторые оксиды являются веществами с молекулярным строением, другие имеют ионную строение.
Основные и кислотные оксиды проявляют разные свойства. Основные оксиды при нагревании могут вступать в реакции с кислотными и амфотерными оксидами, с кислотами. С водой непосредственно реагируют оксиды щелочных металлов (оксиды лития, натрия, калия, рубидия и цезия) и окислы щелочноземельных металлов (оксиды кальция, стронция и бария).
Рассмотрим примеры уравнений типовых химических реакций, которые подтверждают указанные свойства основных оксидов.
1. Взаимодействие основного оксида с кислотным оксидом с образованием соли:
2. Взаимодействие основного оксида с амфотерными оксидом с образованием соли:
3. Взаимодействие основного оксида с водой с образованием основания:
4. Взаимодействие основного оксида с кислотой с образованием соли и воды:
Кислотные оксиды могут вступать в реакции с основными и амфотерными оксидами, с растворимыми в воде основаниями (щелочами).
11 стр., 5082 слов
Цели и структура непрерывного образования
. также продолжаться без отрыва от производства. Прерывистость образовательного процесса не противоречит идее непрерывного образования. Непрерывное образование призвано обеспечить гармоничное развитие каждой личности, индивидуализировать обучение, воспитать в каждом человеке .
Многие кислотных оксидов взаимодействуют с водой (исключением является кремний (IV) оксид SiO 2 . Рассмотрим примеры уравнений типовых химических реакций, которые подтверждают указанные свойства кислотных оксидов.
1. Взаимодействие кислотного оксида с основным оксидом с образованием соли:
2. Взаимодействие кислотного оксида с амфотерными оксидом с образованием соли:
3. Взаимодействие кислотного оксида с водой с образованием кислоты:
4. Взаимодействие кислотного оксида со щелочью с образованием соли и воды:
Амфотерными оксидам присущи свойства как основных, так и кислотных оксидов. То есть они могут реагировать как с кислотными, так и с основными оксидами с образованием солей. Кроме того, амфотерные оксиды могут взаимодействовать как с кислотами, так и со щелочами с образованием солей и воды.
4. Способы получения
1. Окисление простых веществ кислородом (сжигание простых веществ):
Метод не применим для получения оксидов щелочных металлов, т.к. при окислении щелочные металлы обычно дают не оксиды, а пероксиды(Na2O2, K2O2).
Не окисляются кислородом воздуха благородные металлы, напрмер, Аu, Аg, Рt.
2. Окисление сложных веществ (солей некоторых кислот и водородных соединений неметаллов):
2ZnS + 3O2 = 2ZnO + 2SO2
2Н2S + 3O2 = 2SO2 + 2Н2О
3. Разложение при нагревании гидроксидов (оснований и кислородсодержащих кислот):
Нельзя пользоваться этим методом для получения оксидов щелочных металлов, так как разложение щелочей происходит при слишком высоких температурах.
4. Разложение некоторых солей кислородсодержащих кислот:
2Рb(NO3)2 2РbО + 4NO2 + O2
Следует иметь в виду, что соли щелочных металлов не разлагаются при нагревании с образованием оксидов.
Заключение
Одной из важнейших таких систем естествознания, на мой взгляд, является химическая наука. Современная химия развивается стремительными темпами, плодотворно сотрудничая с физикой, математикой, биологией и другими науками. Истоки химических знаний лежат в глубокой древности.
В их основе — потребность человека получить необходимые вещества, объяснить взаимодействие веществ для своей жизнедеятельности. Химия очень тесно связана с производством материальных ценностей и является больше практической наукой. Современные достижения химии в ее практической деятельности вносят большой вклад в общее миропонимание, в развитие естественнонаучных знаний, существенно отражаются на состоянии взаимодействия общества с природой. Добавляемые химией и химической производственной практикой знания о природе, о вещах и превращениях веществ, являются основой для формирования мировоззрения человека, развития общих представлений о мире, о природе человека, его деятельности. Еще с древних времен и вплоть до наших дней в развитии научной, в том числе и химической мысли, почти по всем направлениям можно констатировать позитивный и безостановочный прогресс. Научные знания продолжают постоянно углубляться и совершенствоваться.
4 стр., 1950 слов
Химия и повседневная жизнь человека
. различных веществ, продуктов питания, тканей, которые имеют очень сложный химический состав, и все они тесно связаны с жизнью человека, и его деятельностью. (Источник: Химия и пища: Человек- . очистка сточных вод от ПАВ в отстойниках, а в естественных условиях (в водоемах) их частично «съедают» гетеротрофные бактерии, которые входят в состав активного ила. (Источник: http://school.xvatit.com) .
Для формирования у современного человека естественнонаучного способа мышления, целостного мировоззрения необходимы и знания основных положений химии, как одной из важнейших наук, ее исторического развития и современного понимания роли химии для жизни и деятельности человека. Роль вещества и знаний о веществе, природа химических знаний, пути и средства их формирования в историческом развитии — вот то, с чего в можно начать изучение влияния химии на формирование и развитие современного естествознания.
Список использованных источников
[Электронный ресурс]//URL: https://drprom.ru/referat/oksidyi-i-soli-kak-stroitelnyie-materialyipo-himii/
1. Кипер Р.А. Свойства веществ: Справочник. — Хабаровск, 2009. — 387 с.
2. Коренев Ю.М., Овчаренко ., В.П., Егоров Е.Н. Общая и неорганическая химия часть 3, М.: Московский университет 2000. — 36с.
3. Третьяков Ю.Д., Неорганическая химия, том 1, М.: Академия, 2004. -240с.
4. Ахметов, Н. С. Общая и неорганическая химия / Н. С. Ахметов. – 5-еизд.,перераб. идоп. – М.: Высш. шк., 2003. – 744 с.
5. Карапетьянц, М. Х. Общая и неорганическая химия: учебник для вузов / М. Х. Карапетьянц, С. И. Дракин. – 4-еизд., стереотип. – М.: Химия, 2000. – 592 с.
Примеры похожих учебных работ
Как химия влияет на окружающую среду или химическое загрязнение среды промышленностью
. фосфора, частицы и соединения ртути и мышьяка; химические и цементные заводы. Вредные газы попадают в воздух в результате сжигания топлива для нужд промышленности, отопления жилищ, работы транспорта, сжигания и .
Химия в строительстве
. анализ горных пород привёл к развитию геохимии, химии полимеров, нефтехимии. В основе современных строительных технологий лежат химические процессы. Строительство представляет собой важную ветвь химической технологии, использующей .
Нахождение металлов в природе реферат по химии
. Из 107 химических элементов, известных в настоящее время, 85 относятся к металлам. Последние очень распространены в природе и встречаются в виде различных соединений в глубинах суши, в водах рек, озер, морей .
Получение, свойства и применение кислот на основе хлора
. в настоящее время невелико. Растворы хлорноватой кислоты получают действием разбавленной серной кислоты на растворы солей например: В промышленности . и фторирования. Для использования абгазной соляной кислоты взамен синтетической или .
Реферат по химии воздух смесь газов
. меньшее количество пыли. Кроме перечисленных газов воздух постоянно содержат следы (т.е. ничтожные количества) озона, водорода, метана, аммиака, оксидов азота и угарного газа. По мере совершенствования методов газового анализа .
- реферат Нахождение металлов в природе реферат по химии
- реферат Влияние строительных материалов на здоровье человека (2)
- реферат Техногенные продукты как сырье для производства строительных материалов
- реферат Современные строительные материалы для отделки фасадов
- реферат Резервуары для нефти и нефтепродуктов
- реферат Гипсовые строительные материалы и изделия
- реферат Ячеистые бетоны. Пенобетон и газобетон
- реферат Стекло как строительный материал, использование стеклянных конструкций в строительстве
- реферат Инвестиционно-строительный инжиниринг
- реферат Нефтехимическая и химическая промышленность Башкортостана
- Авиационная техника
- Ракетно-космическая техника
- Инженерные сети и оборудование
- Морская техника
- Промышленный маркетинг и менеджмент
- Технологические машины и оборудование
- Автоматизация технологических процессов
- Машиностроение
- Нефтегазовое дело
- Процессы и аппараты
- Управление качеством
- Автоматика и управление
- Металлургия
- Приборостроение и оптотехника
- Стандартизация
- Холодильная техника
- Архитектура
- Строительство
- Метрология
- Производство
- Производственный маркетинг и менеджмент
- Текстильная промышленность
- Энергетическое машиностроение
- Аттестационная работа
- Бакалаврская работа
- Бизнес план
- Бизнес-план
- Дипломная работа
- Домашняя работа
- Контрольная работа
- Курсова робота
- Курсовая работа
- Курсовой проект
- Магистерская работа
- Маркетинговое исследование
- Научно — исследовательская работа
- Отчет по практике
- Реферат
- Семестровая работа
- Семестровая работа
- Сочинение
- Творческая работа
- Тезисный план
- Часть диплома
- Эссе
- О проекте
- Политика конфиденциальности
- Форма для контактов
Все документы на сайте представлены в ознакомительных и учебных целях.
Вы можете цитировать материалы с сайта с указанием ссылки на источник.
Презентация по химии «Строительные материалы на основе оксидов и солей»

В настоящий момент дополнительные накопительные скидки (от 2% до 25%) предоставляются 56.823 образовательным учреждениям . Чтобы узнать, какая скидка действует для всех сотрудников Вашего образовательного учреждения, войдите в свой личный кабинет «Инфоурок».
- Сейчас обучается 51 человек из 31 региона


Курс профессиональной переподготовки
Химия: теория и методика преподавания в профессиональном образовании
Преподаватель химии
8200 руб. 4100 руб.
Базовая скидка для всех: 40%
Дополнительная скидка: 10% ( только до 18 апреля )
К данной скидке мы можем добавить скидку Вашего образовательного учреждения (она зависит от того, сколько Ваших коллег прошло курсы «Инфоурок»)
В настоящий момент дополнительные накопительные скидки (от 2% до 25%) предоставляются 56.823 образовательным учреждениям . Чтобы узнать, какая скидка действует для всех сотрудников Вашего образовательного учреждения, войдите в свой личный кабинет «Инфоурок».


Курс профессиональной переподготовки
Биология и химия: теория и методика преподавания в профессиональном образовании
Преподаватель биологии и химии
от 7900 руб. от 3950 руб.
Базовая скидка для всех: 40%
Дополнительная скидка: 10% ( только до 18 апреля )
К данной скидке мы можем добавить скидку Вашего образовательного учреждения (она зависит от того, сколько Ваших коллег прошло курсы «Инфоурок»)
В настоящий момент дополнительные накопительные скидки (от 2% до 25%) предоставляются 56.823 образовательным учреждениям . Чтобы узнать, какая скидка действует для всех сотрудников Вашего образовательного учреждения, войдите в свой личный кабинет «Инфоурок».
- Сейчас обучается 21 человек из 17 регионов


Химия
240 руб. 120 руб.
Описание презентации по отдельным слайдам:

1 слайд Строительные материалы на основе природных оксидов и солей

2 слайд К строительным материалам, которые создаются на основе природных оксидов и солей, относятся:
керамические материалы;
вяжущие строительные материалы;
стекло.

3 слайд Основные источники сырья для получения строительных материалов:
Песок
Известняк
Глина
Силикаты
Алюмосиликаты

4 слайд Керамические материалы.
Основным сырьем для производства керамических материалов служат различные сорта осадочных горных пород — глин, состоящих преимущественно из алюмосиликатов, каолина, монтмориллонита.

5 слайд Смесь оксидов алюминия и кремния определяют её состав. Частицы, составляющие основу глины, имеют очень маленькие размеры, менее 0,005 миллиметров. Благодаря такой структуре, это вещество имеет аморфную, коллоидную структуру.
Глины способны образовывать с водой пластичную массу. Влажной глине можно придать любую форму. Если глину обжечь при высокой температуре, то она необратимо твердеет.

6 слайд К керамическим изделиям относятся строительный кирпич, черепица, огнеупорные и облицовочные материалы, керамзит, дренажные трубы и др.
Какими свойствами обладает глина, если рассматривать ее как строительный материал?

7 слайд Прежде всего, нужно отметить высокие сцепляющие свойства, благодаря которым древние строители использовали глину как основной элемент различных соединяющих растворов, штукатурок для внутренней и внешней отделки и т.д.

8 слайд Еще одно замечательное качество – способность аккумулировать тепло. Большие массы глины могут накапливать получаемую от солнечных лучей энергию, а с наступлением холодной ночи отдавать ее. Таким образом, глину вполне можно использовать в качестве утеплителя и естественного терморегулятора, который обеспечивает оптимальный микроклимат в помещении.

9 слайд Глина – отличный звукоизолятор. Благодаря необычной структуре материала даже небольшой его слой хорошо поглощает звуковые колебания, надежно защищая помещение от проникновения шума снаружи.

10 слайд Одно из замечательных свойств глины – водонепроницаемость. Даже незначительный по толщине слой данного материала становится надежной преградой на пути воды. В специальной литературе даже можно встретить такое выражение, как глиняный замок, под которым подразумевается защита различных строительных конструкций от губительного воздействия влаги.

11 слайд Говоря о свойствах, которыми обусловлено использование глины в строительстве, нельзя не упомянуть недавнее открытие немецких ученых. Они установили, что в составе глины присутствует редкий металл – радий, которых характеризуется высокими лечебными свойствами. Радий оказывает успокаивающее воздействие на нервную систему человека.

12 слайд Одно из направлений использования глины в строительстве – возведение саманных домов. Главное достоинство таких построек заключается в том, что зимой в них хорошо сохраняется тепло, а летом – прохлада.
Основной строительный элемент в данной технологии – саманные блоки, для изготовления которых используется смесь глины, песка и соломы в определенных пропорциях. Глина используется в этом составе как связующее вещество, за счет которого песок и солома соединяются в единое целое.

13 слайд Главным образом глину используют для производства кирпича. Керамический кирпич красного цвета. Он обусловлена наличием в глине оксида Fe2O3. Эта окраска получается, если обжиг ведут в окислительной атмосфере, т.е. при избытке воздуха.

14 слайд Таким образом, глина – это универсальный материал природного происхождения, сфера применения которого в современном строительстве невероятно широка. Даже сейчас, когда появилось множество новых материалов, использование глины в строительстве, по-прежнему, остается и актуальным, и экономически оправданным.

15 слайд Вяжущие строительные материалы.
Вяжущие строительные материалы представляют собой вещества или смеси веществ, способные при смешивании с водой образовывать вязкую массу, которая постепенно затвердевает.

16 слайд Одним из древнейших строительных материалов является известь. Различают негашеную известь CaO и гашеную известь Ca(OH)2.
Негашеную известь (оксид кальция, CaО) получают обжигом различных природных карбонатов кальция. Реакция обжига обратима и описывается уравнением
CaCO3 → CaО + CO2;

17 слайд Гашение извести сводится к переводу оксида кальция в гидроксид:
CaO + H2O3 → Ca(OH)2;
Эта реакция экзотермическая, т.е. протекает с выделением теплоты, что заметно каждому проводящему операцию гашения.

18 слайд Твердение извести связано с физическими и химическими процессами. Во-первых, происходит испарение механически примешанной воды. Во-вторых, гидроксид кальция кристаллизуется, образуя известковый каркас из сросшихся кристаллов Ca(OH)2 и окружающей частицы песка. Кроме того, происходит взаимодействие гидроксида кальция с CO2 воздуха с образованием карбоната (карбонизация):
Ca (OH)2 + CO2 = CaCO3 + H2О

19 слайд Другим примером вяжущих строительных материалов является цемент.
В Беларуси его производят на одном из крупнейших в Европе предприятий — ОАО «Красносельскстройматериалы».
Для получения цемента в специальных вращающихся печах спекают смесь известняка СаСО3 и глины.

20 слайд При высокой температуре между глиной и известняком происходят сложные химические реакции, приводящие к образованию различных соединений кремния и алюминия. Спеченную массу размалывают и получают порошок серого цвета. Если цемент смешать с водой, то образуется тестообразная масса, которая через некоторое время затвердевает. Это свойство цемента и используется в строительном деле для скрепления, например, кирпичей при сооружении стен.

21 слайд Кроме того, на основе цемента готовят строительные растворы для штукатурки стен и потолков с целью получения ровных поверхностей и защиты от внешних воздействий. Часто в строительные растворы включают смесь двух вяжущих веществ, например цемент и известь.

22 слайд Примерно в третьем тысячелетии до н.э. в строительстве взамен глины в качестве связующего материала стали использовать гипс.
Строительный гипс получают из природного минерала – гипсового камня CaSO4·2H2O или из минерала ангидрита CaSO4, а также из отходов некоторых отраслей химической индустрии.

23 слайд Гипсовый камень при нагревании примерно до 140°C теряет часть воды и переходит в алебастр (полуводный гипс CaSO4·0,5H2O) в соответствии с уравнением
CaSO4·2H2О = CaSO4·0,5H2О + 1,5H2О
Строительный гипс получают прокаливанием природного гипса или ангидрита при температуре около 1300°C. по реакции:
CaSO4 = CaO + SO3

24 слайд В строительстве из гипса изготавливают сухую штукатурку, плиты и панели для перегородок, стеновые камни, архитектурные детали, вентиляционные короба и др.
Гипсовые изделия характеризуются сравнительно небольшой плотностью, несгораемостью и относительно невысокой теплопроводностью.

25 слайд Из смеси цемента, песка и воды с добавлением мелкого щебня или гравия получают бетон. При смешивании цемента со шлаком получают шлакобетон. Если в бетон ввести каркас из железных стержней, то получается железобетон. Введение в бетон химических веществ определенного состава позволяет получать пенобетон.

26 слайд Сырьем для силикатного кирпича служит известь и кварцевый песок.
Химическая сущность процесса твердения силикатного кирпича такова: при высокой температуре значительно ускоряется кислотно-основное взаимодействие гидроксида кальция Ca(OH)2 с диоксидом кремния SiO2 с образованием соли – силиката кальция CaSiO3. Образование последнего и обеспечивает связку между зернами песка, а следовательно, прочность и долговечность изделия.

27 слайд За рубежом при строительстве и эксплуатации грунтовых и щебеночных дорог для их обеспыливания широко используют растворы CaСl2.
За летний сезон дорогу поливают 3-4 раза 75%-ным раствором этой соли. Отметим также, что CaCl2 ускоряет твердение бетона и увеличивает морозостойкость строительных растворов.

28 слайд Стекло
Чаще всего мы сталкиваемся со стеклами на основе различных силикатов, и в быту слово «стекло» употребляется для обозначения именно силикатных стекол. Кроме красивого внешнего вида, стекло обладает низкой теплопроводностью и высокой прозрачностью, что позволяет использовать его в окнах зданий.

29 слайд При нагревании стекло легко вытягивается в тонкие, длинные нити, из которых изготавливают стекловату, стекловолокно и стеклоткани.
Стекловата и стекловолокно используются в качестве звуко- и теплоизоляторов. Ткани, изготовленные из стекловолокна, обладают высокой химической стойкостью, огнестойкостью и электроизоляционными свойствами.

30 слайд Для получения силикатного стекла (как говорят в промышленности, «при варке стекла») в качестве исходных материалов используют SiO2 (песок), Na2CO3 (соду) и СаСО3 (мел или известняк). Исходную смесь веществ нагревают до температуры 800—1400 °С и получают обычное оконное стекло, состав которого можно условно описать формулой Na2O CaO 6SiO2.

31 слайд Часто при варке стекла для придания ему специфических свойств и окраски в исходную смесь добавляют разнообразные соли и оксиды.
Добавление оксида свинца(II) РbО позволяет получить хрусталь — стекло, сильно преломляющее лучи света.

32 слайд Из чистого оксида кремния(IV) получают так называемое кварцевое стекло. Кварцевое стекло устойчиво при нагревании до 1000—1200 °С. У кварцевого стекла есть еще одно важное достоинство: оно пропускает ультрафиолетовые лучи.

33 слайд В строительстве широко используется так же жидкое стекло.
Это водный раствор силиката натрия – натриевой соли кремниевой кислоты.
Жидкое стекло придает крепость и лоск штукатурке, цементам и другим материалам. Его используют для пропитки рыхлых грунтов с целью их упрочнения и закрепления. На основе растворимого стекла при добавлении наполнителей и модификаторов получают силикатный клей, который применяют для склеивания керамики, стекол, асбеста, металлов и других материалов.

34 слайд На основе жидкого стекла изготавливают искусственные камни. Они получаются в результате смешения стекла с различными (чаще минеральными) наполнителями. Отформованную массу помещают в раствор хлорида кальция CaСl2 или сульфата алюминия A12(SO4)3 (алюминиевых квасцов). Это приводит к затвердению массы и образованию камня.

35 слайд СПАСИБО
ЗА ВНИМАНИЕ!
Рабочие листы и материалы для учителей и воспитателей
Более 8 000 дидактических материалов для школьного и домашнего обучения
Подберём педагога лично для Вас и запишем на бесплатное вводное занятие!
- подготовка к ЕГЭ/ОГЭ и ВПР
- по всем предметам 1-11 классов
Узнать подробнее
Рекордно низкая стоимость занятий!

IV Международный практический «Инфофорум» для педагогов
2023 год педагога и наставника: вызовы и решения
- Дата: 22 апреля 2023 года
- Формат: онлайн
Основные материалы и их соединения в строительстве
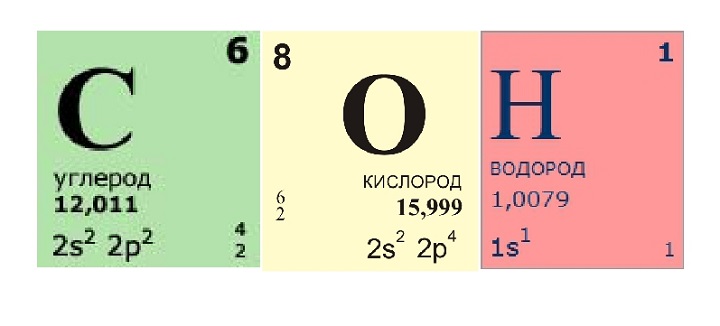
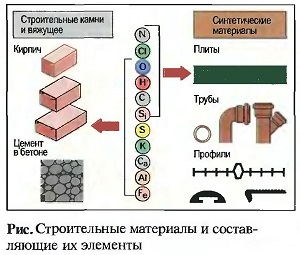
Большинство строительных материалов — это смеси из различных химических соединений, которые, в свою очередь, состоят из элементов. Наряду с элементами углеродом (С), водородом (Н) и кислородом (О) строительные материалы и вяжущие содержат калий (Ка), кальций (Са), кремний (Si), алюминий (Аl) и железо (Fe). Синтетические материалы в основном содержат хлор (Сl) и азот (N) (рис.»Строительные материалы и составляющие их элементы»).
Кислород (О)
СВОЙСТВА: Кислород без запаха, без вкуса, бесцветный газ тяжелее воздуха. Он необходим для горения и для дыхания, но сам не горит. В чистом кислороде сгорают многие вещества, даже металлы, быстро и полностью.
 | 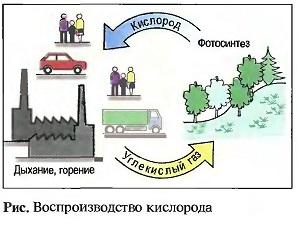 |
ПРОИСХОЖДЕНИЕ: почти 21 % воздуха составляет свободный кислород. Большая часть кислорода содержится в каменной массе земной коры и в воде в химически связанном состоянии. Кислород выделяется растениями с помощью фотосинтеза из углекислого газа (рис. «Воспроизводство кислорода»).
ПРИМЕНЕНИЕ: Кислород применяется при сварке и резке металлов, для производства стали и в качестве кислородного разделителя бетона и заполнителя.
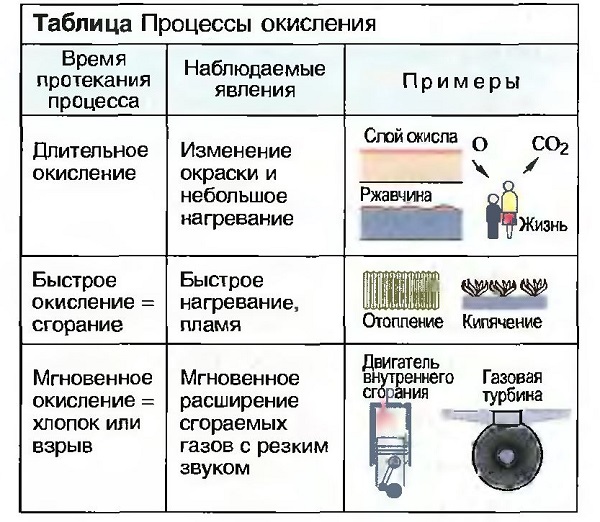
Окисление, Восстановление (раскисление)
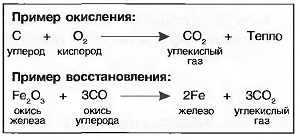
Когда вещество соединяется с кислородом, то говорят об окислении, а возникшее при этом вещество называют оксидом или окислом. При любом окислении выделяется тепло. Окисление может происходить быстро или медленно по времени (табл. «Процессы окисления»).
Если у окисла отнимается кислород, то говорят о восстановлении (раскислении). Для раскисления необходимо тепло. Получение многих металлов из их руд происходит путем восстановления.
Водород (Н)
СВОЙСТВА: Водород — бесцветный газ без запаха. Он является самым легким из всех веществ. 1 литр весит 0,09 г. Смесь водорода и кислорода в соотношении 2:1 очень взрывоопасна.
Источник https://drprom.ru/referat/oksidyi-i-soli-kak-stroitelnyie-materialyipo-himii/
Источник https://infourok.ru/prezentaciya-po-himii-stroitelnie-materiali-na-osnove-oksidov-i-soley-3789313.html
Источник https://www.ocenin.ru/osnovnye-materialy-i-ih-soedineniya-v-stroitelstve/





